Die World Federation of Neurology (WFN) hat den 22. Juli zum Welttag des Gehirns, den Gründungstag der WFN im Jahr 1957, ausgerufen. Aus diesem Grund soll sich heute bei FOAMio auch alles um das Gehirn drehen und vor allem um die Veränderungen und Auswirkungen im Gehirn bei psychiatrischen Erkrankungen, also die Neuropsychologie und -biologie gehen.
Neurologische und psychiatrische cerebrale Erkrankungen machen etwa 13 % der globalen Krankheitslast aus und Schlaganfälle sowie Verletzungen von Schädel und Hirn sind weltweit die führenden Ursachen für Behinderungen. Volkswirtschaftlich verursachten neurologische und psychiatrische Erkrankungen in Europa im Jahr 2010 laut European Brain Council ca. 798 Milliarden €.
Schlaganfälle sind weltweit die zweithäufigste Todesursache nach dem akuten Koronar-Syndrom und neurologische Erkrankungen sind für 12 % aller Todesfälle verantwortlich. Diese hohen Zahlen bilden leider nicht die Bettenanzahl in Kliniken weltweit ab, denn nur 9 % der Menschen weltweit verfügen über mehr als ein Bett pro 10.000 Einwohner. In reichen Ländern gibt es im Schnitt mit drei Neurologen pro 100.000 Einwohner und in einkommensschwachen Staaten sind es nur ca. 0,03 Neurologen pro 100.000 Einwohner.
Das Gehirn im Allgemeinen

Servier Medical Art by Servier is licensed under a Creative Commons Attribution 3.0 Unported License
Das Gehirn ist das Zentrum des zentralen Nervensystems (ZNS). Von hier aus werden alle bewussten und eine große Zahl der unbewussten Vorgänge gesteuert und im Gehirn ist auch der Sitz der Gefühle, Empfindungen und Gedanken. Das Gehirn macht ca. 2 % des gesamten Körpergewichtes aus (Gewicht bei Männern ca. 1375 g; Gewicht bei Frauen ca. 1245 g).
Einteilen lässt sich das Gehirn in die folgenden Bereiche, die nachfolgend kurz beschrieben werden:
Großhirn (Telencephalon)
Im Großhirn befinden sich die höheren Funktionen des Gehirns, es ist das Integrationszentrum des ZNS und der Sitz des Bewusstseins. Es bildet äußere Hirnoberfläche, welche aus vielen Auffaltungen und Furchen besteht. Das Großhirn lässt sich einerseits in die zwei Hemisphären, welche durch eine Längsfurche (Fissa longitudinalis) getrennt ist, sowie die vier Lappen einteilen. Die vier Lappen teilen sich folgendermaßen auf:
- Zentralfurche trennt Stirnlappen (grün) und Scheitellappen (blau)
- seitliche Großhornfurche trennt Schläfenlappen (gelb) vom Scheitellappen (blau)
- Scheitel-Hinterhauptsfurche begrenzt Hinterhauptslappen (violett) nach vorne

Servier Medical Art by Servier is licensed under a Creative Commons Attribution 3.0 Unported License
Strukturell betrachtet baut sich das Großhirn wie folgt von außen nach innen auf:
- Die Großhirnrinde bedeckt das Gehirn zu allen Seiten, macht ca. 70 % aller Neuronen aus und untergliedert sich in einzelne Rindenfelder:
- motorische Rindenfelder (Neurone mit Verbindung zur Skelettmuskulatur, um diese zu steuern)
- sensorische Rindenfelder (Neurone, die die Eindrücke der Sinnesorgane über Afferenzen empfangen)
- optische Rindenfelder (Sehrinde im Okzipitallappen)
- akustische Rindenfelder (Hörzentrum im Temporallappen)
- gustatorische Rindenfelder (im Lobus insularis)
- Die weiße Substanz, auch Leitungsbahnen genannt, besteht aus Nervenfaserbündeln. Die Bündel verbinden die einzelnen Teile des Gehirns über die folgenden Bahnen
- Kommissurenbahnen (verbinden linke und rechte Großhirnhemisphäre)
- Assoziationsbahnen (verbinden einzelne Areale einer Hemisphäre)
- Projektionsbahnen (verbinden Großhirn mit tiefer gelegenen Gehirnteilen und Rückenmark)
- Großhirnkerne (Anhäufungen von grauer Substanz, z.B. Teile der Stammganglien und ein Teil des limbischen Systems wie die Amygdala)
Wie oben schon erwähnt ist das Großhirn der Sitz des Bewusstseins und vieler weiterer Prozesse, wie z.B.
- Motorik im Gyrus praecentralis (Hirnwindung vor der Zentralfurche)
- Empfindungen von Haut, Muskeln, Organen im Gyrus postcentralis (Hirnwindung hinter der Zentralfurche auf dem Parietallappen)
- Sprechen und Sprachverständnis
- Geräuschwahrnehmung in der Area temporalis granulosa im Temporallappen
- Sprachwahrnehmung im Gyrus temporalis superior im Temporallappen
- Sprachverständnis im Wernicke-Sprachzentrum (Areal innerhalb des Temporal- und Teilen des Parietallappens)
- Koordination der Sprechmotorik im Gyrus frontalis inferior (Hirnwindung des unteren äußeren Frontallappens)
- Sehen über das primäre und sekundäre Sehfeld im Okzipitallappen
- Emotionen über Amygdala, Hippocampus sowie Teile des Hypothalamus
- Gedächtnisfunktionen
- Kurzzeitgedächtnis im Frontallappen
- Langzeitgedächtnis auf der gesamten Rinde
- deklaratives Gedächtnis (Lernprozesse expliziter Inhalte wie Fakten & Ereignisse) v.a. im Hippocampus
- nicht-deklaratives Gedächtnis (Speicherung von Erfahrungen und Fähigkeiten bzw. emotionales lernen) v.a. in der Amygdala
Betrachtet auf die Aufteilung als einzelne Großhirnlappen, so ergibt sich folgende Verteilung wichtiger Funktionen auf die einzelnen Areale
| Großhirnlappen | wichtige Zentren | wichtigste Funktionen |
|---|---|---|
| Stirnlappen (Lobus frontalis) | motorisches Rindenfeld, Broca-Areal | – motorische Aktivitäten – Sprache und Wortwahl – Persönlichkeit – Urteilsvermögen, Planung – Kontrolle der Emotionalität – Assoziationen |
| Scheitellappen (Lobus parietalis) | sensorisches Rindenfeld | – Zentrum der sinnlichen Aufmerksamkeit – Berührungsempfindungen – Zuordnung & Gebrauch von Objekten |
| Schläfenlappen (Lobus temporalis) | Wernicke-Areal, Hörrinde | – Hören und Verstehen des Gehörten – Wiedererkennen – Bedeutungsgebung |
| Hinterhauptslappen (Lobus occipitalis) | Sehrinde | – Bildverarbeitung – räumliches Sehen – Farbunterscheidung – Abschätzung von Bewegungen |
Kleinhirn (Cerebellum)
Das Kleinhirn ist der zweitgrößte Teil des Gehirns und teilt sich ebenfalls in zwei Hemisphären auf. Es ist zum Beispiel verantwortlich für…
- das Gleichgewicht im Urkleinhirn,
- den Muskeltonus im Altkleinhirn,
- Koordination und Feinabstimmung willkürlicher Muskelaktivität im Neukleinhirn.
Zwischenhirn (Diencephalon)
Das Zwischenhirn kann man als Schaltzentrale zwischen dem Großhirn und Mittelhirn ansehen. Dort befinden sich Epiphyse, Thalamus und der Hypothalamus, welcher über den Hypophysenstiel mit Hypophyse verbunden ist. Im Zwischenhirn findet die Steuerung der folgenden Funktionen statt:
- Hypothalamus
- Temperaturregulation
- Kontrolle des Wasser- & Salzhaushalt
- Sitz des Durst- & Hungerzentrum
- Beteiligung an Steuerung von Verdauung und Funktion der Blase
- Herstellung von Neurohypophysen-Hormonen sowie Steuerung der Adenohypophyse
- Teil des lymbischen Systems, also Steuerung & Entstehung von Gefühlen
- Produktionsort von ADH und Oxytocin
- Epiphyse
- Steuerung des Tages- & Nachtrhythmus über das Hormon Melatonin
- Hypophyse
- Hormon-Bildung und -Sezernierung von ACTH, TSH, FSH, LH, STH, MSH & Prolaktin im Epiphysen-Vorderlappen sowie Hormon-Bildung und -Sezernierung von ADH und Oxytocin im Epiphysen-Hinterlappen
- Thalamus („Tor zum Bewusstsein“)
- Filterung von Informationen aus Außen- und Innenwelt (Schutz vor Reizüberflutung)
- Umschaltstation vor Großhirnrinde für sensorische Reize sowie Sehen & Hören
- Ort der Entscheidung, welche Informationen bewusst werden
- Ort des Schmerzgedächtnis
Hirnstamm
Der tiefste Abschnitt im Gehirn ist der Hirnstamm und dieser ist z.B. mitverantwortlich für das Kreislauf-, Atem-, Brech- & Miktionszentrum sowie die Bewusstseinsregulation. Der Hirnstamm besteht aus folgenden Teilen:
- Der kleinste Hirnabschnitt, das Mittelhirn (Mesencephalon), ist eine Art von Neuronenschleife zwischen Groß- & Kleinhirn und sorgt z.B. für die Abstimmung von Muskeltonus und Körperhaltung oder die Steuerung der Augenmuskeln und besitzt Dopamin-produzierende Zellen in der schwarzen Substanz.
- Die Brücke (Pons) besitzt viele Bahnen, die das Großhirn über das Kleinhirn mit Medulla oblongata verbinden.
- Das verlängertes Mark (Medulla oblongata) ist der Übergang vom Gehirn zum Rückenmark. Hier sitzt das…
- Kreislaufzentrums, welches für die Steuerung von Herzschlag, Herzmuskelkontraktilität und Blutgefäßweite verantwortlich ist.
- Atemzentrums, welches für die Steuerung des Grundrhythmus von In- & Exspiration verantwortlich ist.
- Reflexzentrums, welches für die Steuerung von Schlucken, Husten, Niesen und Brechen verantwortlich ist
Exkurs: Limbisches System
Anders als die zuvor genannten Bereiche des Gehirns ist das limbische System keine anatomische, sondern funktionelle Einheit, welche aus verschiedenen Teilen von Großhirn, Zwischenhirn und Mittelhirn besteht. Hier werden die meisten endokrinen, vegetativ-nervalen und psychischen Funktionen gesteuert.
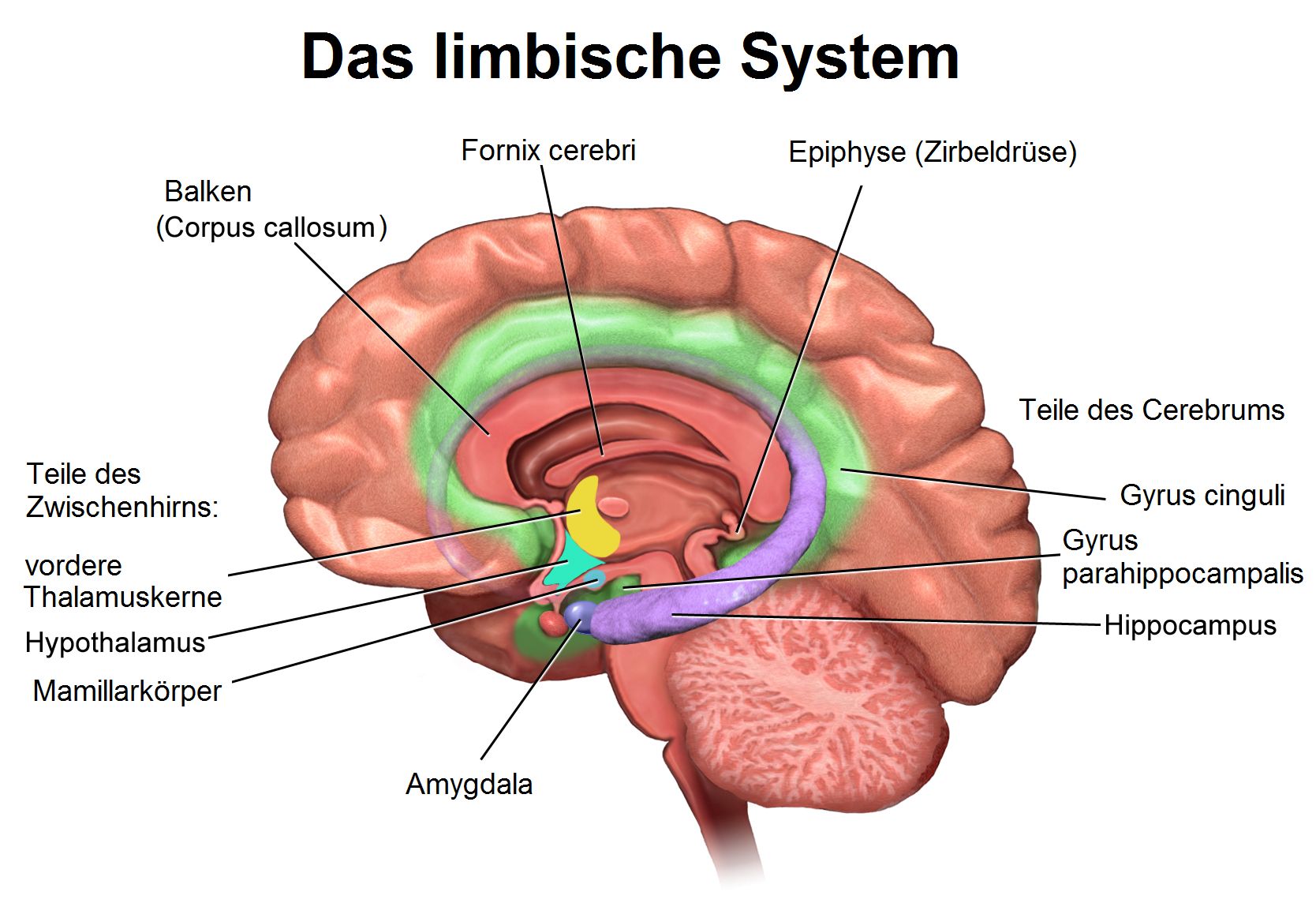
Nachfolgend sei kurz zusammengefasst, welche Funktionen die einzelnen Teile des limbischen Systems haben:
- Hippocampus: Beteiligung an Gedächtnisbildung; Beeinflussung vegetativer und emotionaler Funktionen
- Fornix cerebri: Verbindung limbisches System mit Hypothalamus; Beteiligung an Einspeicherung von Inhalten in Kurzzeit- in das Langzeit-Gedächtnis; Relevanz bei Lernprozessen
- Mamillarkörper (Corpus mamillare): Beteiligung an Gedächtnisbildung; Beeinflussung Sexualfunktion)
- Gürtelwindung (Gyrus cinguli): Beeinflussung vegetativer Funktionen; Verantwortung für psycho- und lokomotorischen Antrieb
- Mandelkern (Amygdala, Corpus amygdaloideum): Speicherung von emotional bewegenden Gedächtnisinhalten; Beeinflussung vegetativer und sexueller Funktionen
- Nucleus anterior des Thalamus: Beteiligung an Modulation der Konzentration sowie am Lernen und episodischem Gedächtnis
- Habenulae (Epithalamus)
- Gyrus hippocampi (Gyrus parahippocampalis): Informationsweiterleitung aus anderen Teilen des limbischen Systems an Hippocampus
- Septum pellucidum: Beteiligung an Bewusstsein, Schlaf und Emotionen sowie Nahrungssuche, Sexualfunktion und Fight-or-flight-Reaktion
- Subiculum: vermutlich letzte und entscheidende Hierarchieebene der Informationsverarbeitung des Hippocampus
Neuropsychologie psychiatrischer Erkrankungen
Der nachfolgende Überblick über die Ursachen und/oder Auswirkungen sowie „Örtlichkeiten“ psychiatrischer Erkrankungen auf das Gehirn soll einen groben neuropsychologischen Überblick bieten und erhebt keinen Anspruch der absoluten Vollständigkeit.
Motivationsstörungen
1973 postulierte Alexander Romanowitsch Lurija seine Vermutung, dass er das Handlungsregulationssystem im präfrontalen Kortex und somit dort die Steuerung und Regulation von Handlungen verortet sieht. Gestützt werden kann diese Vermutung auf zahlreiche Berichte von Motivationsstörungen bei Patient*innen mit präfrontalen Läsionen. Darüber hinaus wiesen viele der Betroffene auch Läsionen im Bereich der Basalganglien und des Thalamus auf.
Eine weitere relevante Rolle bei Motivationsstörungen wird dem Belohnungssystem zugerechnet. Hierbei steht vor allem das Dopamin im Mittelpunkt, da Dopamin ein zentraler Neurotransmitter bei der Verarbeitung von Belohnungsreizen zu sein scheint. Dopaminerge Neuronen im Mittelhirn reagieren auf die Verfügbarkeit und Darbietung einer Belohnung. Dopaminerge Neuronen im medialen Temporallappen und im Striatum sorgen für das Erkennen einer Belohnung. Weitere Neuronen im Bereich des medialen Temporallappens und im orbitofrontalen Kortex ermöglichen darüber hinaus die Erwartungen über zukünftige Ereignisse und mögliche Belohnungen.
Ein ähnliches Modell geht davon aus, dass in der Amygdala und Hippocampus im medialen Temporallappen, aber auch anderen Strukturen des limbischen Systems, Informationen verarbeitet werden und die eigentliche motivationale Verarbeitung der Information erfolgt. Spezifischer wird davon ausgegangen, dass in der Amygdala und im orbitofrontalen Kortex der Belohnungswert eines Reizes festgestellt wird.
Schlafstörungen
Wichtig ist es initial zu betonen, dass es sich beim Schlaf um keinen einheitlichen physiologischen Zustand handelt, sondern um einen Zyklus aus einzelnen Schlafstadien. Die gängigste Einteilung dieser Stadien beruht auf den Arbeiten von Rechtschaffen und Kales aus dem Jahr 1968 und unterteilt den Schlaf in die Stadien S1, S2, S3 und S4 sowie REM-Schlaf, wobei die Phasen S3 & S4 den „Tiefschlaf“ darstellen.
Eine wichtige Funktion des Schlafens ist ein Teilprozess der Gedächtnisbildung, welche aus Aufnahme, Verfestigung (Konsolidierung) sowie Abruf von Informationen besteht. Die Aufnahme und der Abruf funktionieren nur bei Wachheit und die Konsolidierung ist vor allem im Schlaf höchst effektiv. Die Verfestigung von Informationen im Gedächtnis erfolgt vor allem in der Amygdala und weiteren Strukturen des limbischen Systems, wie man in bildgebenden Untersuchungen des REM-Schlafes feststellen konnte. Patient*innen mit Läsionen der Amygdala hatten vor allem Probleme beim Behalten emotionaler Gedächtnisinhalte. Weitere Untersuchungen ergaben auch, dass das wiederholte Wecken aus dem REM-Schlaf zu stärkstem Stress führt und somit die Konsolidierung von Informationen stört.
Weitere Effekte solcher Störungen des REM-Schlafs und die Schlafdeprivation insgesamt sind…
- Verstärkung der Perseverationstendenz
- Verschlechterung Kurzzeit- & Arbeitsgedächtnis
- Reduktion fokussierter Aufmerksamkeit und erhöhte Ablenkbarkeit
- Verlangsamung der Reaktionsgeschwindigkeit
- Beeinträchtigung im divergenten Denken
- unangemessene Risikoabschätzung
- Beeinträchtigte Gedächtnisenkodierung
- Erhöhung der Suggestibilität und Anfälligkeit für irreführende Informationen
- Stimmungsänderungen, Reduktion der Empathiefähigkeit
- Unangemessenheit und Enthemmung sozialen Verhaltens
- Beeinträchtigung der Sprach- und Kommunikationsfähigkeit
Die Schlafdeprivation sorgt einerseits für die stärkere, zentralnervöse Tendenz den »Schlafmodus« zu etablieren und andererseits aufgrund des Stresses für eine erhöhte Freisetzung von Stresshormonen. Mit am stärksten betroffen vom Schlafentzug ist der präfrontale Kortex, der sehr sensibel reagiert und was sich vor allem auf einige der o.g. Frontalhirnfunktionen auswirkt.
Weiter konnte man bei schlafgestörten Menschen erhöhte Herzfrequenzen und eine Aktivierung des Stresshormon Cortisols feststellen. Im EEG sah man bei diesen Patient*innen, dass die oberflächlich gesehen schlafen, aber viele Zeichen vegetativer und zentralnervöser Aktivität zeigten. Kurz gesagt, sie schliefen weniger ruhig. In späteren bildgebenden Verfahren ließ sich auch beobachten, dass Menschen mit Insomnnie viele Hirnareale im Schlaf nicht ausreichend deaktiviert haben, sondern ein sog. Hyperarousal vorliegt. An diesem Hyperarousal-Zustand sind v.a. auch Botenstoffe wie Noradrenalin und Serotonin sowie Orexin im Hypothalamus beteiligt.
In weiteren Arbeiten konnte man das Schlafsystem im Hypothalamus verorten, welcher mit hemmenden Botenstoffen, Gamma-Aminobuttersäure (GABA), arbeitet. Genau diesen Mechanismus machen sich auch viele Medikamente, wie z.B. Benzodiazepine wie Midazolam, zu nutzen. Bei Insomnie-Betroffene waren die GABA-Konzentrationen geringer, die Übererregung im Gehirn erklären könnte. Ein weiterer wichtiger Taktgeber für unsere „innere Uhr“ im Gehirn ist der Nucleus suprachiasmaticus, der ebenfalls im Hypothalamus verortet ist. Dieser ist an der Regulation des zirkadianen Rhythmus beteiligt sind, d.h. primär wirkt er dem steigenden Schlafdruck entgegen und erst zum späten Nachmittag wird dieses Entgegenwirken sukzessive weniger.
Angststörungen
Bei Emotionen wie Wut, Freude oder Angst ist v.a. die Amygdala aktiv. Bei Patient*innen mit Angststörungen ist diese sehr wahrscheinlich überempfindlich, d.h. während einer Panikattacke gibt es im wahrsten Sinne des Wortes ein negatives Feuerwerk in der Amygdala. Zusätzlich ist der präfrontale Kortex von Relevanz. Hier finden Teilprozesse des Entscheidens und Problemlösens statt. Bei Menschen ohne Angststörung sorgt der präfrontale Kortex eigentlich dafür, dass die Amygdala nicht auf solch krassen Hochtouren läuft. Bei Betroffenen ist diese Funktion gestört.
Angstreaktionen sind neurobiologisch betrachtet eine Kaskade von Verschaltungen vieler Nervenzellen des autonomen Nervensystems. Kommt es zu einem angstauslösenden Ereignis, so schaltet der Körper innerhalb von Sekunden in höchste Alarmbereitschaft und stößt aktivitätssteigernde Hormone wie z.B. Adrenalin, Noradrenalin und Cortisol aus. Diese Botenstoffe gelangen, je nachdem, wie der angstauslösende Reiz aufgenommen wird, also beim Sehen über den Sehnerv oder bei Hören über den Hörnerv, ins Zwischenhirn und von dort in das limbische System. Das „Angstsignal“ gelangt dann von der Amygdala als Teil des limbischen Systems zum Thalamus. In der „Umschaltzentrale“ Thalamus wird, sofern der Angstauslöser im emotionalen Gedächtnis mit einem Angstgefühl verknüpft ist, dann automatisch die Angstreaktion ausgelöst. Es kommt zur erhöhten Adrenalinausschüttung und damit zur Tachykardie & -pnoe. Dieser Schritt erfolgt primär unter Umgehung der Großhirnrinde. Im Unterschied dazu bzw. auch im Verlauf der primär automatisch einsetzenden Angstreaktion entscheidet die Großhirnrinde, genauer gesagt der präfrontale Kortex, aufgrund von Erfahrungen über die aufgenommenen Angstreize und wenn der Auslöser von der Großhirnrinde als harmlos eingeschätzt wird, kommt es zur Ausschüttung von hemmenden Botenstoffen, sodass sich Herzschlag und Atmung wieder verlangsamen. Abschließend gilt es noch zu erwähnen, dass neurobiologisch zusätzlich ein Mangel an GABAerger und serotonerger Übertragung ursächlich für Angststörungen und Panikattacken ist.
Kurz gesagt, in Bezug auf die beteiligten Hirnregionen, ist…
- … die Amygdala das Angstgedächtnis.
- … der Hippocampus die Region des Angstlernens und der Bewertung bedrohlicher Situationen.
- … der Hypothalamus als Teil der Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse) verantwortlicht für die Ausschüttung von Stresshormonen.
- … der präfrontale Kortex als bewusstes Kontrollsystem ebenso wie die Amygdala dazu befähigt, die Angstreaktion einleiten oder stoppen.
Weitere Untersuchungsdaten deuten des Weiteren darauf hin, dass auch der Locus coeruleus und die Raphe-Kerne im Hirnstamm an der Entstehung von Angstreaktionen beteiligt sein könnten, v.a. in Abhängigkeit von der Art der Angststörung (soziale Phobie, spezifische Angststörung, Panikstörung, generalisierte Angststörung, Zwang).
affektive Störungen
Die Gruppe der affektiven Störungen umfasst die depressiven sowie die bipolaren, also manisch-depressiven, Störungen.
Auf neurobiologischer Ebene gibt es viele Befunde, die für Probleme der serotonergen, noradrenergen bzw. dopaminergen Neurotransmission sprechen. Bei der Übertragung von Reizen zwischen den Nervenzellen wirken diese Neurotransmitter in Abhängigkeit ihrer Konzentration im synaptischen Spalt verstärkend oder modulierend. Auf der Suche nach Ursachen für eine Depression wird davon ausgegangen, dass ein zu niedriger Monoamin-Spiegel (Serotonin, Dopamin und Noradrenalin) einen großen Teil zur Entstehung und Ausprägung beiträgt, da durch den Mangel dieser Neurotransmitter viele neuronale Schaltkreise gestört sind und somit auch die neuronale Reizübertragung beeinträchtigt ist. Zusätzlich gibt es auch Anhaltspunkte, die auf eine Störung der Regulation der HPA-Achse bzw. Schilddrüsen-Achse mit Hyperkortisolismus hindeuten. CRF-produzierende Neuronen aktivieren die Hypophyse und dadurch kommt es über weitere Einzelschritt zu einer höheren Ausschüttung von Cortisol in der Nebennierenrinde. Dadurch ist der gesamte Körper in erhöhter Alarmbereitschaft, was Symptome wie Unruhe, Schlafstörungen und ein permanentes, meist unterbewusstes Stresserleben bedingt. Diese hormonellen Veränderungen erklären auch sehr gut, wieso Frauen öfters betroffen sind, denn die regelmäßigen Hormonumschwünge, wie bei der Menarche, Menstruation, Schwangerschaft, Geburt oder Menopause, einen zusätzlichen Stressor des Hormonsystems darstellen. Das beste Beispiel hierfür, ist die postnatale Depression.
Bei den bildgebenden Verfahren sieht das Bild der affektiven Störungen, v.a. aber der Depression, streckenweise eher uneinheitlich aus. Ursächlich sind hierbei v.a. methodische, aber auch klinische Gründe, da die affektiven Störungen eher ein Symptomkomplex sind.
Relevante Auffälligkeiten im Gehirn bei unipolaren affektiven Störungen gibt es z.B. in Form von subkortikalen und periventrikulären Signalanhebungen, aber auch Volumenreduktionen im posterioren anterioren Zingulum und im Frontalhirn sind zu beobachten. Von dieser Volumenreduktion sind v.a. das dorsolateral-präfrontale Marklager, der mediale orbitofrontale Kortex sowie der dorsolaterale präfrontale Kortex betroffen. Darüber hinaus ließen sich auch Auffälligkeiten in der Amygdala (Ort der Entstehung von Emotionen und des Emotionsgedächtnis), den Basalganglien sowie dem Zerebellum identifizieren. Es gibt aber auch Ergebnisse, die eine stärkere Aktivierung des dorsolateralen präfrontalen Kortex, des anterioren Gyrus cinguli sowie des medialen Orbitofrontalkortex zeigten. Auch im Hypothalamus kommt es durch eine Vergrößerung von selbigem zu einer stärkeren Aktivierung in Form eines erhöhten Cortisol-Spiegels, also von unserem Stresshormon.
Bei rezidivierenden Depressionen ist zusätzlich eine Reduktion des Hippokampusvolumens zu beobachten, was ein Hinweis auf chronische Stressreaktionen sein könnte.
Bei bipolaren Störungen kommt es zu Läsionen des dorsolateral-präfrontalen Marklagers, aber auch zur Vergrößerung des dritten Ventrikels und Volumenminderungen des Kleinhirnwurmes. Weitere Verlust an Volumen gibt es bei der grauen Substanz, bei gleichzeitig ausbleibender Zunahme bei den Verbindungen der weißen Substanz. Es gibt aber auch gegenteilige Studien, wie z.B. von Krabbendam et al. aus dem Jahr 2000, die keinen Zusammenhang zwischen strukturellen, cerebralen Veränderungen und einer verminderte neuropsychologische Leistung bei bipolaren Patient*innen zu finden sind.
Spannend war auch, dass im Rahmen von Untersuchungen heraus kam, dass das Blut von Patient*innen mit einer bipolaren Erkrankung scheinbar toxische Auswirkungen auf die Gehirnzellen (bedeutender Verlust der Neuriten-Dichte) habe und es so zu Beeinträchtigung der Konnektivitätsfähigkeit der Neuronen kommt.
Bei affektiven Störungen in ihrer Gesamtheit konnte ein erhöhter Glukosemetabolismus in der Amygdala und dem ventromedialen orbitofrontalen Kortex sowie der Insula nachgewiesen werden, bei gleichzeitiger Minderung der Funktionen des dorsolateral-präfrontalen, lateral-orbitofrontalen und parietalen Kortex. Dies könnte auf eine inverse Ralation von präfrontaler Aktivität und Depressionsschwere hindeuten. In verschiedenen Studien konnte auch eine Hyperaktivität der Amygdala insgesamt aufgezeigt werden.
Zwangsstörung
Neurophysiologisch ist zum Beispiel eine erhöhte Aktivität des dorsalen Gyrus cinguli mit stereotypen Verhaltensmustern verknüpft.
Auf der pharmakologischen Ebene gab es vor allem Auffälligkeiten bei den serotonergen und dopaminergen Neurotransmittern, was Rückschlüsse auf eine Beteiligung der Basalganglien, des Belohnungssystems und des Frontalhirns zulässt.
Befunde von Positronen-Emmission-Tomografien bei Patient*innen mit Zwangsstörungen zeigen dazu passende veränderte Aktivierungsmuster bzw. einen Hypermetabolismus im orbitofrontalen Kortex, dem anterioren Gyrus cinguli, medialen präfrontalen Arealen, dem vorderen Teil des Striatums sowie im Nukleus accumbens. Der Gyrus cinguli hat in Zusammenhang sehr wahrscheinliche herausragende Stellung, da diese Region für die Verarbeitung von Fehlern und das Konfliktmonitoring verantwortlich ist.
Schaut man sich die Hirnanatomie an, so erhält eher uneinheitliche Ergebnisse. Es fanden sich Volumenvergrößerungen als auch Verkleinerungen des orbitofrontalen Cortex, Nucleus caudatus, Putamens, der Amygdala, des Cerebellums und der Insula.
Spannend hierbei sind hier zum Beispiel Untersuchungen des Physiologischen Instituts der Universität Würzburg, welche bei Mäusen das Proteins SPRED2 entfernten und es dadurch zu einem übersteigertem Sauberkeitsverhalten kam. Diese Ergebnisse sind von Relevanz, da dieses Protein vor allem in den Basalganglien und im Bereich der Amygdala zu finden sind. Dieses Ergebnis lassen aber keinen Schluss auf eine rein singuläre Ursache für Zwangsstörungen. Weiterhin muss von einer multifaktoriellen Genese ausgegangen werden.
Weitere Forschende fanden heraus, dass es eine schlechtere Konnektivität innerhalb einiger Schlüsselnetzwerke im Gehirn geben könnte, die für die fehlende Flexibiltät und auch die schlechten zielgerichteten Fähigkeiten von zwangsgestörten Menschen verantwortlich sein könnten. Ursächlich sein laut den Studienautoren vor allem gestörte Konnektivität innerhalb diskreter frontostriataler Nervenbahnen.
posttraumatische Belastungsstörung (PTBS)
Die Symptomatik einer PTBS lässt sich zum einen in die Dissoziation zwischen explizitem und implizitem Gedächtnis sowie zum anderen Konzentrations- und Aufmerksamkeitsdefizite im Rahmen des Hyperarousals aufteilen.
Vor allem die Symptome beim Hyperarousal sind wahrscheinlich auf eine Dysfunktion des Frontallappens und der Hippocampus-Amygdala-Formation, v.a. durch eine verstärkte Amygdalaaktivierung, zurückzuführen. Tierversuche konnten zum Beispiel belegen, dass das Aussetzen der Tiere ggü. Stressoren funktionelle und morphologische Veränderungen im Hippokampus bewirkte. Ursächlich ist hierbei die stressinduzierte Konzentrationserhöhung von Glukokortikoiden und Erhöhung von Aminosäuren wie Glutamat. Beide Stoffe haben eine zytotoxische Wirkung auf den Hippocampus. Da der Hyppocampus von entscheidender Rolle bei der Gedächtnisbildung ist, sind zytotoxische Einwirkungen auf selbigem hochproblematisch, da diese ggf. dazu führen, dass traumatische Ereignis nicht als „normale Erinnerung“ gespeichert werden, sondern quasi fehlgespeichert werden, was zum unwillkürliche Abrufen der Erinnerungen an das traumatische Erlebnis und damitzu quälende Flashbacks führt.
In PET-Scans im Rahmen größerer Untersuchungen mit betroffenen Patient*innen, welche mit traumatischen Situationen konfrontiert wurden, zeigte sich eine rechtsseitige Erhöhung des regionalen zerebralen Blutflusses (rCBF) im medialen orbitofrontalen Kortex, der Insula, der rechten Amygdala, des medialen Temporallappens und im sekundären visuellen Kortex sowie eine zeitgleiche rCBF-Reduktion im mittleren Temporallappen und im linken inferioren Frontallappen. Neurobiologisch lässt sich konstatieren, dass neben der überaktivierten Amygdala, welche für das Erkennen und Einstufen von Gefahren zuständig ist, der ventromediale präfrontale Cortex in seiner Aktivität gemindert ist. Dieser Bereich der Hirnrinde kontrolliert bei gesunden Menschen die Furchtreaktion.
Bei der Unterscheidung der beiden o.g. Symptomgruppen Dissoziation und Hyperarousal zeigen Patient*innen vom Hyperarousal-Typ v.a. eine verminderte präfrontale und erhöhte limbische Aktivierung und Patient*innen vom dissoziativen Typ neuronal eher Auffälligkeiten in Form verminderter limbischer und erhöhter präfrontaler Aktivität hatten.
Betrachtet man das Phänomen der Dissoziationen auf neurobiologischer Ebene, so ist eine dysfunktionale Ausschüttung (hemmend und verstärkend) von Substanzen wie Glutamat, Norepinephrin, Epinephrin, Glukokortikoiden, endogenen Opiaten etc. zu beobachten, welche im Hippocampus und präfrontalem Kortex besonders dysfunktional ist. Ob die Ausschüttung hemmend oder verstärkend wirkt, ist wahrscheinlich konzentrationsabhängig. In ihren Grundzügen ist die Dissoziation neurobiologisch/-pharmakologisch sehr ähnlich der Entstehung von Angst. Die wichtigsten neurobiologischen Prozessachsen sind das sympathomedulläre System sowie die Hypothalamus-Hypophysen-Nebennierenrinden-Achse, wobei das sympathomedulläre System für die Ausschüttung von Adrenalin und Noradrenalin und die Hypothalamus-Hypophysen-Nebennierenrinden-Achse für die Ausschüttung von Kortikoiden aus der Nebennierenrinde verantwortlich ist. All diese Stoffe sorgen für Anspannung und Stress im Körper. Schon Ende der 90er Jahre zeigten Untersuchungen, dass die Adrenalin- und Kortikosteroid-Ausschüttung sowie die Beteiligung des sympathischen Nervensystems und des Amygdaloidkomplexes verantwortlich für die Speicherung emotionaler Inhalte im Gedächtnis sind.
Ein weiterer neurobiologischer Problemfaktor ist der gestörte Kontrollmechanismus im mesialen präfrontalen Kortex, welcher die Top-down-Verarbeitung (konzeptgesteuerte Informationsverarbeitung durch höhere mentale Prozesse) moduliert und die Stresshabituation steuert. Diese Störung im mesialen präfrontalen Kortex kann bei chronischem Stress oder akut steigendem Stress bei PTBS-Patient*innen zum Zusammenbruch der zuvor beschriebenen Regulation führen.
Abhängigkeit
Bei suchterkrankten Menschen kommt es vor allem im Dopaminsystem zu nachhaltigen molekularen Veränderungen im Gehirn. Dopamin ist der Botenstoff, der das Belohnungssystem steuert. Das Belohnungssystem merkt sich, welche Stoffe zu einer besonderen Belohnung geführt haben und sorgt damit dafür, dass das Verlangen nach den belohnenden Substanzen immer stärker wird.
Wichtig für das Entstehen einer Suchterkrankung ist Zusammenspiel präfrontal-corticaler Netzwerke und des dopaminergen mesolimbischen Systems, v.a. des Nucleus accumbens im ventralen Striatum („Lustzentrum“). Bei zunehmender Abhängigkeit wandert die Aktivierung dann zusätzlich vom ventralen Striatum in das dorsale Striatum. Diese Wanderung ist wahrscheinlich ursächlich dafür, dass Betroffene mehr und mehr die Kontrolle verlieren.
Es gibt quasi keinen Suchtstoff, der nicht im dopaminergen Belohnungssystem ansetzt, darunter z.B. Amphetamine (erhöhte Ausschüttung von Dopamin in den synaptischen Spalt), Kokain (Hemmung der Wiederaufnahme von Dopamin in die präsynaptische Endigungen), Cannabis oder Opioide (teilweise Wirkung über Dopaminsystem).
Um Handlung auszuführen, müssen die neuronalen Signale den Weg über die Basalganglien, quasi eine Kommandozentrale für die Handlungsausführung, nehmen. In Tierexperimenten konnte man feststellen, dass bei Suchterkrankungen deutliche Spuren in Bezug auf Gewohnheitsmuster hinterlassen werden. Kurz um stellte es sich so dar, dass je stärker eine Gewohnheit ist, desto schneller reagierten die Neurone in den Basalganglien.
Wenn man sich also von einer Handlung nichts erhofft und diese dann plötzliche eine unerwartete Belohnung bringt, dann moduliert das Dopaminsignal im Nucleus accumbens die synaptische Übertragung an den Neuronen so, dass in den Basalganglien, die eher nach dem „Alles-oder-Nichts“-Prinzip arbeiten, der direkte Pfad der Suchtmitteleinnahme aktiviert wird und der Pfad, der dieses Verhalten ggf. stoppen oder bremsen würde, gehemmt wird.
Alkohol
Kurz gesagt handelt es sich bei Abhängigkeitserkrankungen um die Folgen längerfristiger Interaktion zwischen Suchtmittel, Rezeptormembran und einer veränderten Gentranskription. Bezogen auf den Alkohol bedeutet das, dass Ethanol eine kurzfristig entspannende Wirkung hat, da es hemmend auf die N-Methyl-D-Aspartat-Rezeptoren einwirkt. Diese Wirkung kann aufgrund der Wirkung von Gamma-Aminobuttersäure (GABA) an inhibitorischen Rezeptoren noch verstärkt werden.
Das „Problem“, welches bei Suchterkrankungen entsteht, ist, dass durch den wiederholten Konsum Neuroadaptionen vonstattengehen, die die Nervenzelle so verändern, dass diese daraufhin kompensatorisch die Zahl und das Ansprechverhalten der substanzassoziierten Rezeptoren anpasst. Zusätzlich bewirkt die regelmäßige Suchtmitteleinnahme, dass die dopaminergen Neuronen im Belohnungssystem sensitiver werden bzgl. suchtassoziierter Stimuli („Craving“). Das Ergebnis dieser Prozesse ist die Toleranzentwicklung. Kommt es nun zum Entzug vom Alkohol, so kommt es im Gehirn zu einer Übererregung, welche zu den typischen entzugsbedingten Stressreaktionen führt.
Betrachtet man nun die Toleranzentwicklung neuroanatomisch auf funktioneller Ebene, so zeigte die Mehrheit an Untersuchungen eine gesteigerte Aktivität von Nucleus caudatus, Thalamus und Amygdala, welche vor allem als Reizverstärker wirkt, bei suchtassoziierten Reizen. Später erweiterte man dieses Zusammenspiel noch um den dorsolateral-präfrontalen Kortex, also das Arbeitsgedächtnis, sowie die anterioren Anteile des Gyrus cinguli , welcher für die suchtassoziierte Aufmerksamkeitsmodulation zuständig ist. Im Gesamtbild entsteht so ein großes Netzwerk der motivationalen Impulsgenerierung und Verhaltenskontrolle.
Wichtig waren auch Arbeiten, die zeigten, dass nicht nur die Gabe von Suchtmitteln, sondern auch die Präsentation suchtassoziierter visueller Reize zu einer Aktivierung mesolimbischer und mesokortikaler dopaminerger Neuronen führte. Diese Interaktionen sind gleichzusetzen mit dem problematischen verstärkerassoziierten Lernen bei Suchtkrankheiten.
Bezüglich der zentralnervösen Schäden, die der Genuss von Alkohol anrichtet, lässt sich konstatieren, dass schon bei Gelegenheitstrinker*innen, aber vor allem bei aktiven und trockenen Alkoholiker*innen eine klare Korrelation zwischen eingenommener Alkoholmenge und geschädigter grauer Hirnsubstanz zu beobachten ist. Diese Schäden waren i.d.R. im präfrontalen Kortex, der Insula, den Temporallappen mit dem Hippocampus sowie dem Kleinhirn zu verorten.
Im Zusammenhang mit der Alkoholabhängigkeit ist vor allem auch das Korsakoff-Syndrom zu erwähnen. Hierbei handelt es sich i.d.R. um eine Folgeerscheinung einer akuten Episode einer Wernicke-Enzephalopathie. Die typischen Symptome wie Blicklähmungen, Nystagmus, Ataxie und Verwirrtheit bilden sich zwar wieder zurück, hinterlassen aber eine starke Beeinträchtigung des Gedächtnisses. Beim Korsakoff-Syndrom kommt es durch Läsionen im Thalamus und den Mamillarkörpern zu der zuvor erwähnten Gedächtnisstörung. Unklar ist immer noch zu großen Teilen in welchem Zusammenspiel Dienzephalon, Hippocampus und das basale Vorderhirn neben dem Thalamus und den Mamillarkörpern agieren.
In post mortem stattgefundenen Untersuchungen des Hirngewebes von Menschen mit einem chronisch exzessivem Alkoholkonsum fand man auch starke Atrophie der weißen Substanz, v.a. im präfrontalen Bereich. Diese Atrophie korreliert mit der Menge und Dauer des Alkoholkonsums und ist bei Abstinenz weitestgehend reversibel. Ursächlich für die Volumenminderung sind wahrscheinlich strukturelle Veränderungen der Myelinisierung der Nervenzellen. Darüber hinaus belegen neuropathologische Studien einen Verlust frontaler kortikaler Neuronen und Dendriten. Im Geschlechter-Vergleich kommt zusätzlich noch zum Tragen, dass Frauen zwar weniger bzw. seit weniger Jahren tranken als Männer, aber trotzdem stärker geschädigt waren.
Essstörungen
Bei den meisten von Essstörungen betroffenen Personen ist zu beobachten, dass es zu einer Hirnatrophie kommt. Hierbei ist vor allem die graue Substanz in der Hirnrinde betroffen. Im Gegenzug erweitern sich die mit Liquor gefüllten Bereiche des Gehirns. Ursächlich für das Schrumpfen des Gehirns ist wahrscheinlich die erniedrigte Protein-Biosynthese aufgrund der Mangelernährung – es werden also zu wenig Proteine hergestellt, um mit selbigen die Nervenzellen fortlaufend zu reparieren oder zu regenerieren.
Bezogen auf die Gruppe der Anorexie-Patient*innen lässt sich aber konstatieren, dass das Schrumpfen des Gehirns scheinbar reversibel, sobald das Gewicht der Betroffenen wieder steigt. Leider kommt es aber trotzdem zu relevanten Schäden der Astrozyten, also Gliazellen, die an vielen wichtigen Hirnfunktionen beteiligt sind.
Spannende Indizien einer Studie aus Nature Neuroscience (doi:10.1038/nn.4136), zeigten dass es sich bei der Anorexia nervosa tatsächlich um eine Sucht handeln könnte und die Nahrungsverweigerung damit nicht alleinige dem freien Willen der Patient*innen unterliegt. Ausschlaggebend für diese Vermutung sind, dass die Auswahl der Nahrungsmittel durch Regionen des Gehirns angeregt wird, welche auch bei Substanzabhängigkeiten aktiviert sind. Jedoch gibt es bezüglich dieser Indizien auch gegenteilige Untersuchungen, welche Aktivierung im dorsalen Striatum bei der Nahrungswahl detektierten und somit der These des fehlenden freien Willen widersprechen, da die gesunden Patient*innen in der Kontrollgruppe kein aktiviertes Striatum hatten und auch nicht die Kontrolle über die Wahl der Nahrungsmittel verloren.
Weitere Hinweise in Bezug auf die neurobiologische/-anatomische Pathogenese anderer psychischer Erkrankungen deuten in Richtung der Geschlechtshormone Östrogen und Testosteron, welche von Relevanz für die Hirnentwicklung in der Pubertät sind. So sorgt eine Magersucht z.B. für eine Östrogen-Mangel und damit für ein Ausbleiben der Hirnentwicklung, wovon vor allem der Hippocampus und die Amygdala betroffen sind. Sind diese zwei Areale gestört, so ist das Risiko erhöht, später Depressionen oder eine Angststörung zu entwickeln.
Spannend sind darüber hinaus Ergebnisse einer Studie, die zeigten, dass bei Betroffenen von Essstörungen die Reihenfolge der Signalweiterleitung des Hungersignals gestört ist. Laut der Untersuchung trifft das Hungersignal nicht zuerst im Hypothalamus ein und wird dort verarbeitet, sondern gelangt initial in die Bereiche des Gehirns, welche die Motivation beeinflussen. Dies könnte einen Erklärungsansatz bieten, weshalb Betroffene ihr Hungergefühl einfacher kontrollieren bzw. ignorieren können, denn das Gefühl der Angst vor der Gewichtszunahme setzt nachfolgend die Signale des Hypothalamus zur Essensaufnahme außer Kraft.
Ein weiterer cerebral relevanter Bereich könnten die in der grauen Substanz vorhandenen und für die Verarbeitung von Körperbildern zuständigen Hirnregionen sein, denn bei Betroffenen, die eine Körperbildtherapie absolvierten, war die Zahl der grauen Zellen höher und somit stärker nutzbar für die bessere Einschätzung des eigenen oder fremden Körperbildes.
Betrachtet man die Gruppe der Bulimiker*innen, so zeigen Untersuchungsergebnisse, dass diese einen verminderten Blutfluss in einem, mit der Selbstreflexion verbunden Teil des Gehirns, dem Precuneus, hatten. Daraus lässt sich schließen, dass betroffene Personen mit der Aufnahme von Nahrung auf neuropsychologischer Ebene negative, auf sich bezogene Assoziationen vermeiden bzw. überdecken zu versuchen.
Schizophrenie
Schon Emil Kraeplin ging 1893 in seiner Konzeption der „Dementia praecox“, welche heute unter dem Begriff Schizophrenie bekannt ist, von einer progredienten Neurodegeneration bei Ausbruch der Erkrankung aus. Auch heute ist diese Hypothese noch heiß diskutiert. Jedoch fehlen bis heute noch klare Nachweis neuroanatomischer Veränderungen, die so stark ausgeprägt sind, dass sie das normale Maß in Bezug auf das Altern übersteigen.
Was als gesichert gilt, sind Ventrikelvergrößerungen (Seitenventrikel, 3. Ventrikel) und Vergrößerungen der Sulci sowie kortikale Volumenminderungen. Weitestgehend gesichert sind zusätzlich folgende Volumenreduktionen, vorwiegend mit Abnahme grauer Substanz:
- Temporallappen, mindestens medial in der Hippocampus-Formation, womit der Ort der akustischen und Sprachwahrnehmung sowie der Gedächtnisbildung betroffen sind
- Frontallappen, v.a. dorsolaterale Areale, womit der Ort der Handlungsplanung/-kontrolle, Motivation, des abstrakten Denkens, der Aufmerksamkeit und von sozialen Fertigkeiten sowie des Arbeitsgedächtnisses betroffen sind
- Thalamus, mindestens gewisse Kernen, womit relevante für die subkortikokortikale und kortikokortikale Kommunikation verantwortliche Teile betroffen sind
Schaut man sich die Über- und Unteraktivierungen einzelner Hirnregionen an, so sind vor allem die folgenden Bereiche betroffen:
- motorische Areale des Frontalkortex (Broca-Gebiet)
- primärer Hörkortex
- Wernicke-Areal
- anteriorer Teil des Gyrus cinguli (bei halluzinierenden Patienten)
Bei Betrachtung einiger schizophrener Subsyndrome konnten mittels Positronenemissionstomographie (PET) konnten folgende Bereiche ausgemacht werden:
- verminderte präfrontale und links parietale Aktivität sowie erhöhte Aktivität im Kaudatum bei psychomotorische Verarmung (Sprach-, Affekt-, Bewegungsarmut)
- verminderte Aktivität im rechten Cingulum und dem rechten posteriore Temporallappen, erhöhte Aktivität im ventralen Striatum sowie funktionelle Auffälligkeiten im linken Temporallappen bei Realitätsverzerrung (Halluzination, Wahn)
- verminderte Aktivität rechts frontotemporal, im Broca-Zentrum und dem rechten/linken Gyrus angularis sowie erhöhte Aktivität im anterioren Cingulum und dem mediodorsalen Thalamus bei esorganisation (Formale Denkstörungen)
- frontothalamostriatalen Dysfunktion bei Störungen in der Zeitschätzung
- fehlende Aktivierung des anterioren Gyrus cinguli bei kognitiver Interferenz
- spontane Aktivierung des Heschl-Gyrus und sekundär akustischer Areale beim Stimmenhören
- Aktivität temporaler und präfrontaler auditiver Verarbeitungsareale bei akustischen Halluzinationen, welche durch kortikosubkortikale auditive Netzwerke generiert werden
- verminderter Blutfluss im dorsolateralen präfrontalen Kortex bei psychomotorischem Antriebsmangel
- abnormal erhöhter Blutfluss im dorsalen Gyrus cinguli und im Thalamus bei Desorganisationssyndrom
Wie diese Aufzählung schon signalisieren, sind keine fokalen Störungen einzelner zerebraler Anteile ursächlich, sondern mehrere Anteile als großes System, welches unter einer Dyskonnektion infolge gestörter Modulation zentraler Integrationsschaltstellen wie dem anterioren Gyrus cinguli leiden.
Die meisten Modelle der Pathogenese der Schizophrenie sehen die schizophrenen Negativsymptome und neuropsychologische Defiziten wie Arbeitsgedächtnisstörungen in präfrontalen Funktionseinbußen und die schizophrenen Positivsymptome in einer sekundären Enthemmung der subkortikalen Dopaminsekretion, einer temporolimbischen Volumen- und Konnektivitätsverminderung sowie einer Supersensitivität des D2-Rezeptors im mesolimbischen System begründet.
Ein interessanter Erklärungsansatz für eine Ursache einer Schizophrenie ist das Gen SAP97. Wenn dieses defekt ist, steigt das Risiko einer schizophrenen Erkrankung um das 40-fache. Doch bis Anfang 2022 wusste man zwar, dass das Risikogen SAP97 Teil einer Gruppe von Proteinen ist, welche Synapsenfunktion und -reaktionen in Bezug auf den Neurotransmitter Glutamat beeinflussen. In einer 2022 in Natur publizierten Arbeit konnten Hering et al. den Wirkort von SAP97 ausmachen. Dieser liegt im Gyrus dentatus, einer Unterstruktur im Hippocampus, welcher eine Art Türsteher für eingehende Reize und Informationen ist. Die Untersuchungen zeigten, dass es bei einem Defekt des SAP97 zu einer Überregung der Synapsen im Gyrus dentatus kommt.
Neurobiologisch betrachtet haben viele schizophrene Patient*innen eine erhöhte Dopamin-Ausschüttung, welche Zusammenhänge mit den Schizophrenie-typischen Symptomen aufweist. In einer Arbeit der Medizinischen Universität Wien konnte man darüber hinaus herausfinden, dass zusätzlich auch eine verminderte Regulation der Dopaminausschüttung bestimmter Gehirnareal symptomauslösend ist.
Eine andere Arbeit zeigt, dass schizophrene Menschen durchschnittlich eine dünnere Großhirnrinde haben. Dies ist relevant, da Bereiche wie der Frontallappen eine wichtige Rolle bei der Erinnerung, Aufmerksamkeit, Phantasie sowie Motivation spielt und der Temporallappen z.B. Bereiche umfasst, die unter anderem mit dem Hören, der Sprache, der Namensgebung und dem Gedächtnisspielen zu tun haben. All diese Funktionen sind mehr oder minder stark beeinträchtigt im Rahmen einer Schizophrenie. Die Untersuchung konnte auch eine Korrelation zwischen der kortikalen Dicke in mehreren Hirnregionen und Symptomschwere, dem früheren Beginn und einer längeren Dauer der Erkrankung herstellen.
Zum Schluss möchte ich noch eine interessante Studie der Cambridge University ansprechen. Diese zeigte, dass unser Gehirn dazu in der Lage sein könnte, Auswirkungen einer schizophrenen Erkrankung umzukehren. Die Untersuchungsergebnisse beschreiben einen, unabhängig von der Krankheitsschwere stattfindenden Prozess der Reorganisation der Gehirne schizophrener Patient*innen, mit dem Ziel Schäden zu beschränken.
Demenzen
Betrachtet man die Gruppe der Demenzen, so kann man grob zwischen den drei folgenden Gruppen unterscheiden:
- Die Alzheimer-Demenz ist mit einer Verbreitung von 60 bis 70 % die häufigste Demenzenform. Histopathologisch handelt es sich um β-Amyloid-Ablagerung zwischen den Nervenzellen sowie die Umwandlung zytoskeletaler Elemente und eine reaktive Gliazellvermehrung. Zusätzlich kommt es vor allem im Temporal- und Parietallappen zu einer sichtbaren Atrophie, v.a. des posteriorem Gyrus cinguli und Präcuneus. Die ersten neuropathologischen Veränderungen zeichnen sich im mediobasalen Temporallappen in der sog. klinisch stummen Phase ab. Sobald die neuropathologischen Prozesse den Hippokampus erreichen, kommt es zu ersten Störungen des Lernens und des Gedächtnisses. Die relevante Schwelle für die Diagnostik einer Demenz ist das Fortschreiten des Krankheitsprozesses auf den Temporal-, Parietal- sowie i.d.R. als Letztes auf den Frontallappen.
- Bei einer vaskulären Demenz handelt es sich um Störungen mit meist relativ geringfügiger intellektueller Leistungsminderung sowie langsam fortschreitenden Demenzzuständen, verortet im Frontallappen und im subkortikalen Bereich. Pathophysiologisch kann man die vaskuläre Demenz als Makroangiopathie große Arterien oder als Mikroangiopathie kleinerer Arterien unterteilen. Histopathologisch kommt es zur Zerstörung relevanter Hirnanteile, der Unterbrechung von Leitungsbahnen und Beeinträchtigung von Neurotransmittersystemen, was zu kognitiven und affektiven Beeinträchtigungen führt. Weitere pathologische Veränderungen, die zur Entstehung kognitive Störungen beitragen, sind z.B. die Häufung kortikaler und subkortikaler sowie subkortikaler Infarkte, wobei letztere in Kombination mit ausgedehnten Marklagerschäden auftreten können.
- Die Lewy-Körper-Krankheit/Demenz, benannt nach Frederic H. Lewy, beschreibt eine dementielle Form, bei welcher es vor allem im Frontalkortex und Hippokampus zu einer Atrophie kommt, unter Beteiligung des cholinergen Systems. Im Unterschied zur Alzheimer-Demenz bleibt der Temporallappen relativ lange unversehrt. Die für die Erkrankung verantwortlichen Lewy-Körperchen sind kleine Einschlüsse im Zytoplasma von Neuronen in der Großhirnrinde sowie dem Hirnstamm.
- Die frontotemporale Demenz ist die vierthäufigste Demenzursache nach den drei zuvor genannten. Wie der Name schon sagt, handelt es sich hierbei um fokale Degenerationen frontaler und temporaler Hirnstrukturen. Typisch ist die Atrophie des vorderen und unteren Temporallappens – bei i.d.R. gleichzeitig erhaltenen hinteren Teilen des Temporallappens und ausgespartem Gyrus temporalis superior -, welche sich nicht nur auf subkortikale Bereiche, also Basalganglien, Amygdala, weiße Substanz, sondern meist auch auf den Hippokampus ausdehnt. Im Frontallappen sind vor allem orbitobasale, ventromediale und dorsolaterale Anteile betroffen. Weitere Folgen aus der oben beschriebenen Degenerationen von Frontal- und Temporallappen sind gemäß Lund-und-Manchester-Kriterien eine semantische Demenz (SD) oder eine primär progressive Aphasie (PPA).
Borderline-Persönlichkeitsstörung
Die Ergebnisse vieler bildgebender Untersuchungen in Bezug auf die Borderline-Persönlichkeitsstörung sind in ihrer Gesamtheit eher inkonsistent. Der einzig durchgehend konsistente Befund ist eine verringertes Hippocampusvolumen. Es gibt aber auch Hinweise auf eine Volumenminderung der Amygdala, präfrontaler Areale, aber teilweise auch parietaler Areale. Funktionell waren vor allem der präfrontale und anteriore cinculäre Cortex auffällig.
Spannend ist es auch, dass in einigen Studien eine Hyperaktivität der Amygdala bei Konfrontation mit emotional negativen Reizen identifiziert werden konnte. Zusätzlich wiesen diese Untersuchungen auf eine verringerte Aktivität des Neokortex sowie des orbitofrontalen, des ventrolateralen und des dorsolateralen präfrontalen Kortex und des dorsale anteriore zinguläre Kortex hin. Diese Regionen sind an der kognitiven Kontrolle also der Verhaltensregulation beteiligt, v.a. der dorsale anteriore zinguläre Kortex stellt eine Art Alarmsystem bei körperlichem als auch bei sozialem Schmerz dar.
Hinweise auf neuroendokrinologischer Ebene bzgl. einer Fehlregulation der Hypothalamus-Hypophyse-Nebennierenrinde-Achse (HHNA) sind in ihrer Gesamtheit eher inkonsistent. In einigen Untersuchungen ließ sich aber eine erhöhte Kortisol-Konzentration nachweisen. Sollte eine Beeinflussung der HHNA bestehen, so ist diese wahrscheinlich auf kindliche Traumata zurückzuführen. Ebenfalls im neuroendokrinologischen Kontext konnte ein niedrigerer Oxytocin-Spiegel bei Menschen mit einer Borderline-Persönlichkeitsstörung detektiert werden. Oxytocin wird auch als Bindungshormon bezeichnet und ist einer der Gegenspieler des Stresshormons Kortisol.
Andere Theorien deuten auf eine erhöhte Aktivität spezifischer Spiegelneuronen hin, was die emotionale Überempfindlichkeit erklärt. Diese Spiegelneuronen sind im präfrontalen und im sensorischen Cortex des Gehirns zu finden. Sie werden schon bei der Beobachtung von Handlungen und die Fremdwahrnehmung von Gefühlen stimuliert und sind elementar für das Lernen durch Nachahmung und das Nacherleben von Emotionen.
tiefgreifende bzw. neuronale Entwicklungsstörung
Das bekannteste Beispiel für eine Erkrankung aus der Gruppe der tiefgreifenden Entwicklungsstörungen sind die Autimus-Spektrum-Störungen.
Initial zu betonen ist, dass es genügend Befunde gibt, die gegen eine singuläre neurobiologische Ursache für die variable Ausprägung von Autismus-Symptomen spricht. Dies zeigen auch die uneinheitlichen pathogenetischen bzw. pathocerebralen Auffälligkeiten in einer Vielzahl von Untersuchungen. Was aber festgestellt werden konnte, ist, dass alle beteiligten Hirnregionen über Bahnen miteinander verbunden sind. In Studien detektierte bzw. als beteiligt identifizierte Hirnbereiche waren zum Beispiel das Großhirn, das limbische Systems, das Zerebellum sowie Bereiche unter der Olive.
Weitere Auffälligkeiten waren z.B.
- eine erhöhte Regionaldurchblutung des linken Frontallappens, welche vermutlich mit einer Dysfunktion einhergeht.
- die Aktivierung des Gyrus temporalis inferior rechts zur Erkennung von Gesichtern in einem emotionalen Kontext, was auffällig ist, da neurotypische Menschen diesen Bereich des Frontallappens für die Erkennung von Objekten nutzen.
- Abweichungen in der weißen Substanz.
- eine überdurchschnittliche Menge an Zerebrospinalflüssigkeit im Subarachnoidalraum bis ins Alter von 2 Jahren.
Vielen Menschen im Autismus-Spektrum fällt das natürliche Halten von Blickkontakt extrem schwer und auch hier gibt es einige Untersuchungen, die nachweisen konnten, dass Autist*innen bei Blickkontakt eine verringerte rechts dorsal-parietale Aktivität und eine erhöhte rechts ventral temporal-parietale Aktivität hatten. In diesem Bezug konnte sogar eine Korrelation zwischen abnehmender sozialer Fähigkeit auch die neuronale Reaktion auf Augenkontakt in der rechten dorsalen parietalen Region abnimmt.
Untersuchungen der TU Dresden zeigte zum Beispiel auch, dass schon in der subkortikalen Hörbahn in der Großhirnrinde bei der Verarbeitung von Kommunikation Veränderungen auftreten, was wahrscheinlich an einer verringerten Aktivierung des Colliculi inferiores liegt.
Aufmerksamkeitsdefizit/Hyperaktivitätsstörung (ADHS)
Dopamin hat eine entscheidende Rolle bei Hyperaktivität und damit auch bei einer Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung. Kommt es zu Läsionen im dopaminergen System des präfrontalen Kortex, führen diese zu Hyperaktivität. Bei der Herleitung der Entstehung von ADHS kommt v.a. die Dopaminhypothese zum Zuge. Diese geht davon aus, dass es bei betroffenen Personen zu einem verminderten Dopaminumsatz kommt. Ein weiterer, wahrscheinlich beteiligter, Botenstoff ist das Serotonin. Dies ließ sich in Versuchen nachweißen, bei denen Mäusen die serotoninergen 5-HT1b-Rezeptoren fehlten und es so zu überaktivem und aggressivem Verhalten kam. Auch der Neurotransmitter Noradrenalin ist mitbeteiligt an der Entstehung einer ADHS. Verschiedene Untersuchungen zeigen, dass Noradrenalin und Serotonin bei der ADHS wahrscheinlich durch Transportenzyme im Synapsenspalt zu rasch abgebaut werden und diese daher weniger lange wirken können und damit eine Erklärung für die Unterfunktion einiger Regionen bieten.
Ein weiteres beteiligtes Hirngebiet ist der noradrenerg innervierte Locus coeruleus, der stärker aktiviert ist, sowie die Basalganglien, der Corpus callosum und das Cerebellum. Des Weiteren konnte man feststellen, dass Kinder mit ADHS ein kleineres Gesamtvolumen der grauen und weißen Substanz und des Kleinhirns hatten. Auch eine Hypoperfusion und ein Hypometabolismus waren in den frontostriatalen Strukturen zu beobachten.
In größeren Meta-Analysen einiger MRT-Studien konnte gezeigt, dass ADHS-Patienten im kognitiven Bereich dissoziierte komplexe Multisystembeeinträchtigungen in mehreren rechts- und linkshemisphärischen dorsalen, ventralen und medialen fronto-zingulo-striato-thalamischen und fronto-parieto-zerebellären Netzwerken aufweisen, also den Bereichen für kognitive Kontrolle, Aufmerksamkeit, Timing und Arbeitsgedächtnis, sowie weitere Anomalien in orbitalen und ventromedialen präfrontalen und limbischen Arealen, die für Motivation und Emotionskontrolle verantwortlich sind.
Weitere Auffälligkeiten waren z.B. …
- … die Dysfunktion des Frontallappens, welcher für die Selbstregulation sog. “Ausführungsfunktionen” (Executive Functions) verantwortlich ist.
- … ein geringeres Volumen des Kleinhirns.
- … eine Dysfunktion des “Belohnungssystems” des Gehirns.
- … strukturelle und funktionelle Auffälligkeiten des Striatums.
- … eine Beeinträchtigung der Kontrollfunktion des Hippocampus.
Suizidalität
Neuropsychologisch & -biologisch ist der Phänomenbereich der Suizidalität ein schwer und bis jetzt auch nur wenig erforschtes Gebiet. Es gibt aber einige Untersuchungen, z.B. zum sog. Salienz-Netzwerk. Das Salienz-Netzwerk ist ein Gebiet, das hauptsächlich aus der anterioren Insula und dem dorsalen anterioren cingulären Cortex besteht und unter anderem die Problemlösung und Impulsivität steuert. Dieses Netzwerk weist vor allem bei Personen mit Depressionen Auffälligkeiten auf. Zusätzlich gibt es einige Hinweise, dass das Salienz-Netzwerk bei suizidalen Menschen weniger starke Verknüpfungen zu anderen Netzwerken wie dem Default-Mode-Netzwerk ausbildet. Das Default-Mode-Netzwerk besteht aus verschiedenen Anteilen des Gehirns, darunter der mediale präfrontale Cortex, der Precuneus, Teile des Gyrus cinguli sowie Lobulus parietalis superior und der Hippocampus.
Eine weitere spannende Untersuchung schaffte es mithilfe eines Naive Bayes-Klassifikator mit hoher Genauigkeit (0,91; p < 0,000001) suizidale Proband*innen zu identifizieren. Der Naive Bayes-Klassifikator bezog sechs stark beteiligte Hirnregionen, nämlich den linken oberen medialen Frontalbereich, das medialen frontalen/anterioren Cingulum, den rechten mittleren Temporalbereich, den linken unteren Parietalbereich und den linken unteren Frontalbereich, mit ein.
amnestische Störungen
Jede*r kennt wahrscheinlich Momente, in denen man bestimmte Dinge vergessen hat. Bei einer Amnesie handelt es sich um die pathologische Form des Vergessens. Patient*innen mit einer Amnesie sind nicht mehr dazu imstande bzw. nur noch eingeschränkt befähigt neue Gedächtnisinhalte zu speichern und/oder und/oder alte Gedächtnisinhalte abzurufen.
Verantwortlich für eine solche Amnesie sind v.a. Schädigungen des Hippocampus, welcher als Teil des limbischen Systems maßgeblich an der Gedächtnisbildung beteiligt ist und quasi als Schaltstelle zwischen Kurz- und Langzeitgedächtnis fungiert. Wichtig ist es zu betonen, dass i.d.R. Hirnregionen, welche für Handlungsabläufe verantwortlich sind, nicht betroffen sind, d.h. Tätigkeiten wie das Zubinden der Schuhe stellen kein Problem dar.
Unterschieden werden muss zusätzlich zwischen dem amnestischen Syndrom, welches eine isolierte, hirnorganisch bedingte Störung des Kurzzeit- oder längerfristigen Gedächtnisses ist, die keine Störungen anderer kognitiven Funktionen wie Aufmerksamkeit oder logisches Denkvermögen beinhaltet, und der transienten globalen Amnesie (TGA), welche eine vorübergehende anterograde, manchmal auch inkomplette retrograde Amnesie des Kurzzeitgedächtnisses für ca. 1 – 24 Stunden ist.
Ursachen für das amnestische Syndrom sind z.B. Schlaganfälle, Traumata, Hypoxie, Epilepsien, Vitaminmangel und Infektionen (Herpesenzephalitis, HIV). Diese Ätiologien sorgen für Störung des medialen Temporallappens (Hippokampusformation), des Thalamus und der Corpora mamillaria.
Ursächlich für eine TGA sind meist multifaktorielle Phänomene mit emotionalen und belastungsbezogenen Triggern sowie vaskulären Störungen und bei jüngeren Patient*innen auch Migräneäquivalente. Alle diese Punkte haben eine passagere Funktionsstörung mediobasaler Anteile des Temporallappen gemeinsam, mit einer zusätzlichen Beteiligung beider Hippocampi. Dies hat man in MRT-Untersuchungen in Form von Läsionen im Hippocampus bei etwa der Hälfte der Patient*innen in MRT-Untersuchungen festgestellt.
Exkurs „Blackout“
Betrachtet man alternativ das Phänomen des „Blackouts“, welches nicht durch Schädigungen oder Anomalien des Hirngewebes bedingt ist, so resultiert das „Vergessen“ hierbei vor allem aus neurobiologischen Prozessen. In stressigen Situationen, die mit einem „Blackout“ einhergehen, kommt es im Rahmen der Stressreaktion mit einer erhöhten Ausschüttung von Glukokortikoiden wie z.B. Cortisol, um dem Gehirn viel Energie zur Verfügung zu stellen. Daraufhin kommt es initial zu einer Leistungssteigerung des Hippocampus, welche dann aber als Schutzmechanismus des Hippocampus stoppt und diesen komplett „ausschaltet“. Grund hierfür ist, dass die Glukokortikoide als Stresshormone in zu hoher Konzentration irreversibel zellschädigend sind. Ergebnis ist, dass die Nervenzellen nicht mehr reagieren, keine Informationen mehr geleitet werden und somit kein Abruf mehr möglich ist.
Quellen
- Abé, Christoph, Christopher R.K. Ching, Benny Liberg, Alexander V. Lebedev, Ingrid Agartz, Theophilus N. Akudjedu, Martin Alda, u. a. „Longitudinal Structural Brain Changes in Bipolar Disorder: A Multicenter Neuroimaging Study of 1232 Individuals by the ENIGMA Bipolar Disorder Working Group“. Biological Psychiatry 91, Nr. 6 (März 2022): 582–92. https://doi.org/10.1016/j.biopsych.2021.09.008.
- ADHS Kompakt-Team. „Einblick bei ADHS: Was passiert im Gehirn?“ ADHS Kompakt e.V. (blog), 17. Juni 2022. https://adhs-kompakt.de/adhs-was-passiert-im-gehirn/.
- ADHS Therapizentrum. „Neurologischer Hintergrund“. ADHS Therapizentrum (blog). Zugegriffen 19. Juli 2023. https://www.adhs-therapiezentrum.de/neurologischer-hintergrund/.
- Amunts, Katrin, und Sebastian Bludau. „Strukturelle Veränderungen im Gehirn bei Depression“. Forschungszentrum Jülich, 19. Mai 2022. https://www.fz-juelich.de/de/aktuelles/news/pressemitteilungen/2015/15-12-17hirnatlas-depression.
- Apergis-Schoute, Annemieke M., Claire M. Gillan, Naomi A. Fineberg, Emilio Fernandez-Egea, Barbara J. Sahakian, und Trevor W. Robbins. „Neural Basis of Impaired Safety Signaling in Obsessive Compulsive Disorder“. Proceedings of the National Academy of Sciences 114, Nr. 12 (21. März 2017): 3216–21. https://doi.org/10.1073/pnas.1609194114.
- apomio.de. „Ursachen des Borderline-Syndroms entschlüsselt? | apomio Gesundheitsblog“. apomio.de – Gesundheitsblog, 12. Mai 2016. https://www.apomio.de/blog/artikel/strukturelle-veraenderungen-im-gehirn-als-ursache-fuer-borderline.
- Ärzteblatt, Deutscher Ärzteverlag GmbH, Redaktion Deutsches. „Neurophysiologie: Gehirnveränderungen durch Traumata“. Deutsches Ärzteblatt, 10. Mai 2019. https://www.aerzteblatt.de/archiv/207148/Neurophysiologie-Gehirnveraenderungen-durch-Traumata.
- ASPI. „Autistische Unterschiede des Gehirns: Konnektivität“. Autismus-Spektrum-Portal (blog), 6. März 2021. https://autismus-spektrum.ch/autistische-unterschiede-des-gehirn-konnektivitaet/.
- Badenschier, Franziska. „Wenn Magersucht das Hirn auszehrt“. dasGehirn.info – der Kosmos im Kopf, 30. Januar 2013. https://www.dasgehirn.info/krankheiten/sucht/wenn-magersucht-das-hirn-auszehrt?limit=all.
- Bellebaum, Christian, Patrizia Thoma, und Irene Daum. Neuropsychologie. 1. Aufl. Basiswissen Psychologie. Wiesbaden: VS, Verl. für Sozialwiss, 2012.
- Bergmann, Moritz. „Autisten-Gehirne Im MRT Klar Unterschiedlich“. pressetext, 8. August 2017. https://www.pressetext.com/news/20170808015.
- Bowe, Steph. „Wie Essstörungen dein Gehirn umprogrammieren“. Vice (blog), 12. Dezember 2016. https://www.vice.com/de/article/7xzvxa/anorexie-veraendert-das-gehirn-sodass-das-hungergefuehl-verschwindet.
- Braun, Urs, Axel Schäfer, Danielle S. Bassett, Franziska Rausch, Janina I. Schweiger, Edda Bilek, Susanne Erk, u. a. „Dynamic Brain Network Reconfiguration as a Potential Schizophrenia Genetic Risk Mechanism Modulated by NMDA Receptor Function“. Proceedings of the National Academy of Sciences 113, Nr. 44 (November 2016): 12568–73. https://doi.org/10.1073/pnas.1608819113.
- Brun, Lucile, Guillaume Auzias, Marine Viellard, Nathalie Villeneuve, Nadine Girard, François Poinso, David Da Fonseca, und Christine Deruelle. „Localized Misfolding Within Broca’s Area as a Distinctive Feature of Autistic Disorder“. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging 1, Nr. 2 (März 2016): 160–68. https://doi.org/10.1016/j.bpsc.2015.11.003.
- Chao, Ivo, und Pschyrembel Redaktion. „Rindenfelder“. Pschyrembel Online, 1. Mai 2018. https://www.pschyrembel.de/Rindenfelder/K0K05.
- Collins, Brittany, Lauren Breithaupt, Jennifer E. McDowell, L. Stephen Miller, James Thompson, und Sarah Fischer. „The Impact of Acute Stress on the Neural Processing of Food Cues in Bulimia Nervosa: Replication in Two Samples.“ Journal of Abnormal Psychology 126, Nr. 5 (Juli 2017): 540–51. https://doi.org/10.1037/abn0000242.
- Dehn, Lorenz B., und Thomas Beblo. „Verstimmt, verzerrt, vergesslich: Das Zusammenwirken emotionaler und kognitiver Dysfunktionen bei Depression“. neuropsychiatrie 33, Nr. 3 (September 2019): 123–30. https://doi.org/10.1007/s40211-019-0307-4.
- Dehn, Lorenz, und Thomas Beblo. „Neuropsychologie der Depression: Zwischen Testdiagnostik und Alltagserleben“, 4–8, 2020.
- Der Standard. „Spiegelneuronen im Gehirn bei Borderline-Patienten gestört“. DER STANDARD, 27. März 2019. https://www.derstandard.de/story/2000100171463/spiegelneuronen-im-gehirn-bei-borderline-patienten-gestoert.
- DocCheck. „Großhirn“. DocCheck Flexikon, 5. Februar 2022. https://flexikon.doccheck.com/de/Gro%C3%9Fhirn.
- DocCheck, Medizinexpert*innen bei. „Limbisches System“. DocCheck Flexikon. Zugegriffen 16. Juli 2023. https://flexikon.doccheck.com/de/Limbisches_System.
- Elmenhorst, David, und Eva-Maria Elmenhorst. „Müdigkeit: Risiko Schlafmangel“. Spektrum.de, 7. Mai 2018. https://www.spektrum.de/news/was-bei-schlafmangel-im-gehirn-passiert/1560834.
- Enke, Kersten, und Anne Stege, Hrsg. Anatomie und Physiologie. 5. Aufl., Erstdruck. Lehrbuch für präklinische Notfallmedizin 1. Edewecht: Stumpf + Kossendey, 2015.
- Fertuck, Eric A., Barbara Stanley, Olena Kleshchova, J. John Mann, Joy Hirsch, Kevin Ochsner, Paul Pilkonis, Jeff Erbe, und Jack Grinband. „Rejection Distress Suppresses Medial Prefrontal Cortex in Borderline Personality Disorder“. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging 8, Nr. 6 (Juni 2023): 651–59. https://doi.org/10.1016/j.bpsc.2022.11.006.
- Foerde, Karin, Joanna E Steinglass, Daphna Shohamy, und B Timothy Walsh. „Neural Mechanisms Supporting Maladaptive Food Choices in Anorexia Nervosa“. Nature Neuroscience 18, Nr. 11 (November 2015): 1571–73. https://doi.org/10.1038/nn.4136.
- for the ENIGMA Bipolar Disorder Working Group, D P Hibar, L T Westlye, N T Doan, N Jahanshad, J W Cheung, C R K Ching, u. a. „Cortical Abnormalities in Bipolar Disorder: An MRI Analysis of 6503 Individuals from the ENIGMA Bipolar Disorder Working Group“. Molecular Psychiatry 23, Nr. 4 (April 2018): 932–42. https://doi.org/10.1038/mp.2017.73.
- Förster, Katharina, Rosa H. Horstmann, Udo Dannlowski, Josselin Houenou, und Philipp Kanske. „Progressive Grey Matter Alterations in Bipolar Disorder across the Life Span – A Systematic Review“. Bipolar Disorders, 19. März 2023, bdi.13318. https://doi.org/10.1111/bdi.13318.
- Geyer, Stefan, und Verena Müller. „Bei Depressionen ist Hirnregion zur Stresskontrolle vergrößert“. Max-Plank-Gesellschaft, 26. September 2018. https://www.mpg.de/12301556/depression-hirnregion-stresskontrolle.
- Goller, Sarah, Hubert Hasel, und Nicole Menche. Mensch Körper Krankheit für den Rettungsdienst. Herausgegeben von Frank Flake und Stephan Dönitz. 2. Auflage. München: Elsevier, 2018.
- Gropp. „Veränderungen im Gehirn von Patienten mit Essstörung erstmals im Kernspintomografen sichtbar gemacht“. Informationsdienst Wissenschaft, 25. Juni 2010. https://idw-online.de/de/news376416.
- Guo, S., L. Palaniyappan, P. F. Liddle, und J. Feng. „Dynamic Cerebral Reorganization in the Pathophysiology of Schizophrenia: A MRI-Derived Cortical Thickness Study“. Psychological Medicine 46, Nr. 10 (Juli 2016): 2201–14. https://doi.org/10.1017/S0033291716000994.
- Hahamy, Avital, Marlene Behrmann, und Rafael Malach. „The Idiosyncratic Brain: Distortion of Spontaneous Connectivity Patterns in Autism Spectrum Disorder“. Nature Neuroscience 18, Nr. 2 (Februar 2015): 302–9. https://doi.org/10.1038/nn.3919.
- Hellerhoff, Inger, Joseph A. King, Friederike I. Tam, Sophie Pauligk, Maria Seidel, Daniel Geisler, Klaas Bahnsen, u. a. „Differential Longitudinal Changes of Neuronal and Glial Damage Markers in Anorexia Nervosa after Partial Weight Restoration“. Translational Psychiatry 11, Nr. 1 (9. Februar 2021): 86. https://doi.org/10.1038/s41398-021-01209-w.
- Hellwig, Bettina. „Essstörungen verändern die Gehirnstruktur“. DAZ.online, 3. Juli 2010. https://www.deutsche-apotheker-zeitung.de/news/artikel/2010/07/03/essstoerungen-veraendern-die-gehirnstruktur.
- Hirsch, Joy, Xian Zhang, J. Adam Noah, Swethasri Dravida, Adam Naples, Mark Tiede, Julie M. Wolf, und James C. McPartland. „Neural Correlates of Eye Contact and Social Function in Autism Spectrum Disorder“. Herausgegeben von Vanessa Carels. PLOS ONE 17, Nr. 11 (9. November 2022): e0265798. https://doi.org/10.1371/journal.pone.0265798.
- Hohmann-Jeddi, Christina. „Transiente globale Amnesie: Wenn das Gedächtnis Pause macht“. Pharmazeutische Zeitung online, 14. Januar 2015. https://www.pharmazeutische-zeitung.de/ausgabe-032015/wenn-das-gedaechtnis-pause-macht/.
- Honey, Christian. „Neurowissenschaft: Die Macht des Kaffees und der Zigaretten“. Spektrum.de, 1. März 2016. https://www.spektrum.de/news/sucht-und-gewohnheit-im-gehirn/1399787.
- Janak, Patricia. „Brain Circuits of Compulsive Drug Addiction Identified“. Nature 564, Nr. 7736 (Dezember 2018): 349–50. https://doi.org/10.1038/d41586-018-07716-z.
- Karnath, Hans-Otto, und Peter Thier, Hrsg. Kognitive Neurowissenschaften. Springer-Lehrbuch. Berlin, Heidelberg: Springer Berlin Heidelberg, 2012. https://doi.org/10.1007/978-3-642-25527-4.
- Kay, Yuni, Linda Tsan, Elizabeth A. Davis, Chen Tian, Léa Décarie-Spain, Anastasiia Sadybekov, Anna N. Pushkin, Vsevolod Katritch, Scott E. Kanoski, und Bruce E. Herring. „Schizophrenia-Associated SAP97 Mutations Increase Glutamatergic Synapse Strength in the Dentate Gyrus and Impair Contextual Episodic Memory in Rats“. Nature Communications 13, Nr. 1 (10. Februar 2022): 798. https://doi.org/10.1038/s41467-022-28430-5.
- Klabunde, Megan, Carl F. Weems, Mira Raman, und Victor G. Carrion. „The Moderating Effects of Sex on Insula Subdivision Structure in Youth with Posttraumatic Stress Symptoms: Klabunde et Al.“ Depression and Anxiety 34, Nr. 1 (Januar 2017): 51–58. https://doi.org/10.1002/da.22577.
- Kohlenbach, Lukas. „Die Neurobiologie der Sucht“. dasGehirn.info – der Kosmos im Kopf, 8. September 2020. https://www.dasgehirn.info/krankheiten/sucht/die-neurobiologie-der-sucht.
- Korte, Martin. „Was passiert bei einem Blackout im Gehirn und was kann man dagegen tun?“ swr.online, 18. Juli 2022. https://www.swr.de/wissen/1000-antworten/was-passiert-beim-blackout-im-gehirn-was-kann-man-dagegen-tun-100.html.
- Koschnick, Antonia. „Die Neurobiologie hinter Angst und Depression – Teil 1: Angst und Panik – neurobiologisch gesehen“. Die Angstzeitschrift, 25. Mai 2022. https://www.angstselbsthilfe.de/daz.digital/angst-und-depression-neurobiologisch-gesehen-teil1/.
- ———. „Die Neurobiologie hinter Angst und Depression – Teil 2: Depression – neurobiologisch gesehen“. Die Angstzeitschrift, 2. Juni 2022. https://www.angstselbsthilfe.de/daz.digital/angst-und-depression-neurobiologisch-gesehen-teil1/.
- Krabbendam, L., A. Honig, J. Wiersma, E. F. P. M. Vuurman, P. A. M. Hofman, M. M. A. Derix, W. A. Nolen, und J. Jolles. „Cognitive Dysfunctions and White Matter Lesions in Patients with Bipolardisorder in Remission“. Acta Psychiatrica Scandinavica 101, Nr. 4 (April 2000): 274–80. https://doi.org/10.1034/j.1600-0447.2000.101004274.x.
- Krauch, Marlene. „Borderline-Persönlichkeitsstörung: Von wegen lebenslänglich“. Spektrum.de, 20. Dezember 2021. https://www.spektrum.de/news/borderline-persoenlichkeitsstoerung-von-wegen-lebenslaenglich/1951726.
- Kuhn, Marion, Florian Mainberger, Bernd Feige, Jonathan G Maier, Volker Mall, Nicolai H Jung, Janine Reis, Stefan Klöppel, Claus Normann, und Christoph Nissen. „State-Dependent Partial Occlusion of Cortical LTP-Like Plasticity in Major Depression“. Neuropsychopharmacology 41, Nr. 6 (Mai 2016): 1521–29. https://doi.org/10.1038/npp.2015.310.
- Lautenbacher, Stefan, und Siegfried Gauggel, Hrsg. Neuropsychologie psychischer Störungen: mit 54 Tabellen. 2., Vollständig aktualisierte und Erweiterte Auflage. Berlin Heidelberg: Springer, 2010.
- Lehrner, Johann, Hrsg. Klinische Neuropsychologie: Grundlagen – Diagnostik – Rehabilitation. 2. Aufl. Wien: Springer, 2011.
- Lepach, Anja C., Gerd Lehmkuhl, und Franz Petermann. „Neuropsychologische Themen in der Kinderpsychologie und Kinderpsychiatrie“. Praxis der Kinderpsychologie und Kinderpsychiatrie 59, Nr. 7 (1. August 2010): 576–87. https://doi.org/10.13109/prkk.2010.59.7.576.
- mgo fachverlage GmbH & Co. KG. „22. Juli ist 1. Welttag des Gehirns“. Healthcaere-in-europe.com, 21. Juli 2014. https://healthcare-in-europe.com/de/news/healthcare-in-europe.com/de/news/22-juli-ist-1-welttag-des-gehirns.html.
- Miller, Danielle R., Scott M. Hayes, Jasmeet P. Hayes, Jeffrey M. Spielberg, Ginette Lafleche, und Mieke Verfaellie. „Default Mode Network Subsystems Are Differentially Disrupted in Posttraumatic Stress Disorder“. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging 2, Nr. 4 (Mai 2017): 363–71. https://doi.org/10.1016/j.bpsc.2016.12.006.
- MRC AIMS Consortium, Saashi A. Bedford, Min Tae M. Park, Gabriel A. Devenyi, Stephanie Tullo, Jurgen Germann, Raihaan Patel, u. a. „Large-Scale Analyses of the Relationship between Sex, Age and Intelligence Quotient Heterogeneity and Cortical Morphometry in Autism Spectrum Disorder“. Molecular Psychiatry 25, Nr. 3 (März 2020): 614–28. https://doi.org/10.1038/s41380-019-0420-6.
- NDR VIsite. „Vorübergehende Amnesie: Wenn das Gedächtnis Pause macht“. NDR Visite, 2. Januar 2022. https://www.ndr.de/ratgeber/gesundheit/Voruebergehende-Amnesie-Wenn-Gedaechtnis-Pause-macht-,tga100.html.
- Neuhaus, Cordula. „Neurobiologie Der ADHS – Menschen Mit ADHS“. Menschen Mit ADHS (blog). Zugegriffen 19. Juli 2023. https://www.menschen-mit-adhs.de/allgemeine-informationen-zu-adhs/neurobiologie-der-adhs/.
- Norman, Luke, Stephan Taylor, Yanni Liu, Joaquim Radua, James Abelson, Mike Angstadt, Yann Chye, u. a. „S20. Error-Processing in OCD: A Meta-Analysis of FMRI Studies and Investigation of Changes Following CBT“. Biological Psychiatry 83, Nr. 9 (Mai 2018): S354. https://doi.org/10.1016/j.biopsych.2018.02.911.
- Osterkamp, Jan. „Hirnforschung: Die Transmitterchemie stimmt nicht“. Spektrum.de, 9. September 2009. https://www.spektrum.de/news/die-transmitterchemie-stimmt-nicht/1007330.
- Pacifico, R, und R L Davis. „Transcriptome Sequencing Implicates Dorsal Striatum-Specific Gene Network, Immune Response and Energy Metabolism Pathways in Bipolar Disorder“. Molecular Psychiatry 22, Nr. 3 (März 2017): 441–49. https://doi.org/10.1038/mp.2016.94.
- Paracelsus Recovery. „Wie Trauma das Gehirn verändert“. Paracelsus Recovery, 24. März 2021. https://www.paracelsus-recovery.com/de/blog-de/wie-trauma-das-gehirn-verandert/.
- Pascoli, Vincent, Agnès Hiver, Ruud Van Zessen, Michaël Loureiro, Ridouane Achargui, Masaya Harada, Jérôme Flakowski, und Christian Lüscher. „Stochastic Synaptic Plasticity Underlying Compulsion in a Model of Addiction“. Nature 564, Nr. 7736 (Dezember 2018): 366–71. https://doi.org/10.1038/s41586-018-0789-4.
- Pues, Maria. „Abhängigkeit: Was im Gehirn passiert“. PTA-Forum online, 23. März 2012. https://ptaforum.pharmazeutische-zeitung.de/ausgabe-042012/was-im-gehirn-passiert/.
- Pujol, Jesus, Laura Blanco-Hinojo, Dídac Maciá, Pino Alonso, Ben J Harrison, Gerard Martínez-Vilavella, Joan Deus, José M Menchón, Narcís Cardoner, und Carles Soriano-Mas. „Mapping Alterations of the Functional Structure of the Cerebral Cortex in Obsessive–Compulsive Disorder“. Cerebral Cortex 29, Nr. 11 (17. Dezember 2019): 4753–62. https://doi.org/10.1093/cercor/bhz008.
- Rubia, Katya. „Cognitive Neuroscience of Attention Deficit Hyperactivity Disorder (ADHD) and Its Clinical Translation“. Frontiers in Human Neuroscience 12 (29. März 2018): 100. https://doi.org/10.3389/fnhum.2018.00100.
- Ryffel, Meinrad. „Wissenschaftliche Erkenntnisse zu ADHS bei Erwachsenen“. Info- und Beratungsstelle für Erwachsene mit ADHS und deren Angehörige (blog). Zugegriffen 19. Juli 2023. https://adhs20plus.ch/wissenschaftliche-erkenntnisse/.
- Sambale, Tobias, Hrsg. Checklisten Anatomie und Physiologie. 2. Auflage. München: Elsevier, 2018.
- Sanofi-Aventis Deutschland GmbH. „Angst – Was passiert im Gehirn“. Mein Sanofi, 11. Mai 2021. https://mein.sanofi.de/themen/angst/angst-was-passiert-im-gehirn.
- Schaer, Marie, und Nada Kojovic. „Autismus verstehen: Was Neurowissenschaften dazu beitragen können“. Bundesamt für Sozialversicherungen (blog), 7. Juni 2019. https://sozialesicherheit.ch/de/autismus-verstehen-was-neurowissenschaften-dazu-beitragen-koennen/.
- Schafer, Simon T., Abed AlFatah Mansour, Johannes C.M. Schlachetzki, Monique Pena, Saeed Ghassemzadeh, Lisa Mitchell, Amanda Mar, u. a. „An in Vivo Neuroimmune Organoid Model to Study Human Microglia Phenotypes“. Cell 186, Nr. 10 (Mai 2023): 2111-2126.e20. https://doi.org/10.1016/j.cell.2023.04.022.
- Schelinski, Stefanie, Alejandro Tabas, und Katharina Kriegstein. „Altered Processing of Communication Signals in the Subcortical Auditory Sensory Pathway in Autism“. Human Brain Mapping 43, Nr. 6 (15. April 2022): 1955–72. https://doi.org/10.1002/hbm.25766.
- Scherk, H., W. Reith, und P. Falkai. „Hirnstrukturelle Veränderungen bei bipolaren affektiven Störungen“. Der Nervenarzt 75, Nr. 9 (Oktober 2004). https://doi.org/10.1007/s00115-004-1706-7.
- Scheurich, Armin, und Lautenbacher, Stefan. „Psychische Störungen mit Ausnahme von Demenz: Die klinische Neuropsychologie ist in die Psychiatrie zurückgekehrt“. InFo Neurologie + Psychiatrie 10, Nr. 6 (2008): 41–45.
- Schmaal, Lianne, Anne-Laura Van Harmelen, Vasiliki Chatzi, Elizabeth T. C. Lippard, Yara J. Toenders, Lynnette A. Averill, Carolyn M. Mazure, und Hilary P. Blumberg. „Imaging Suicidal Thoughts and Behaviors: A Comprehensive Review of 2 Decades of Neuroimaging Studies“. Molecular Psychiatry 25, Nr. 2 (Februar 2020): 408–27. https://doi.org/10.1038/s41380-019-0587-x.
- scinexx. „Säuglinge: Starkes Kopfwachstum enthüllt Autismus“. scinexx – Das Wissensmagazin, 28. November 2011. https://www.scinexx.de/news/biowissen/saeuglinge-starkes-kopfwachstum-enthuellt-autismus/.
- Spektrum.de. „Hirnforschung: Gehirn von Autisten arbeitet ohne Pause“. Spektrum.de. Zugegriffen 20. Juli 2023. https://www.spektrum.de/news/gehirn-von-autisten-arbeitet-ohne-pause/841322.
- Stahl, Axel. „Was steckt neurobiologisch hinter Schlafstörungen?“ dasgehirn.info, 28. März 2013. https://www.dasgehirn.info/aktuell/frage-an-das-gehirn/was-steckt-neurobiologisch-hinter-schlafstoerungen.
- Stahlschmidt, Stephan. „Trauma – Was im Gehirn dabei passiert“. Traumatherapie-Praxis Stephan Stahlschmidt, München | posttraumatische-belastungsstörung.com (blog), 30. Mai 2017. http://posttraumatische-belastungsstoerung.com/trauma-was-im-gehirn-passiert.
- Stange, Jonathan P., Lisanne M. Jenkins, Stephanie Pocius, Kayla Kreutzer, Katie L. Bessette, Sophie R. DelDonno, Leah R. Kling, u. a. „Using Resting-State Intrinsic Network Connectivity to Identify Suicide Risk in Mood Disorders“. Psychological Medicine 50, Nr. 14 (Oktober 2020): 2324–34. https://doi.org/10.1017/S0033291719002356.
- Stark, E.A., C.E. Parsons, T.J. Van Hartevelt, M. Charquero-Ballester, H. McManners, A. Ehlers, A. Stein, und M.L. Kringelbach. „Post-Traumatic Stress Influences the Brain Even in the Absence of Symptoms: A Systematic, Quantitative Meta-Analysis of Neuroimaging Studies“. Neuroscience & Biobehavioral Reviews 56 (September 2015): 207–21. https://doi.org/10.1016/j.neubiorev.2015.07.007.
- Thomas, C., M. Driessen, und V. Arolt. „Diagnostik und Behandlung akuter psychoorganischer Syndrome“. Der Nervenarzt 81, Nr. 5 (Mai 2010): 613–30. https://doi.org/10.1007/s00115-010-3013-9.
- Ullrich, M, M Weber, A M Post, S Popp, J Grein, M Zechner, H Guerrero González, u. a. „OCD-like Behavior Is Caused by Dysfunction of Thalamo-Amygdala Circuits and Upregulated TrkB/ERK-MAPK Signaling as a Result of SPRED2 Deficiency“. Molecular Psychiatry 23, Nr. 2 (Februar 2018): 444–58. https://doi.org/10.1038/mp.2016.232.
- Vaghi, Matilde M., Petra E. Vértes, Manfred G. Kitzbichler, Annemieke M. Apergis-Schoute, Febe E. Van Der Flier, Naomi A. Fineberg, Akeem Sule, u. a. „Specific Frontostriatal Circuits for Impaired Cognitive Flexibility and Goal-Directed Planning in Obsessive-Compulsive Disorder: Evidence From Resting-State Functional Connectivity“. Biological Psychiatry 81, Nr. 8 (April 2017): 708–17. https://doi.org/10.1016/j.biopsych.2016.08.009.
- Van Erp, Theo G.M., Esther Walton, Derrek P. Hibar, Lianne Schmaal, Wenhao Jiang, David C. Glahn, Godfrey D. Pearlson, u. a. „Cortical Brain Abnormalities in 4474 Individuals With Schizophrenia and 5098 Control Subjects via the Enhancing Neuro Imaging Genetics Through Meta Analysis (ENIGMA) Consortium“. Biological Psychiatry 84, Nr. 9 (November 2018): 644–54. https://doi.org/10.1016/j.biopsych.2018.04.023.
- Wahl, Inka. „Magersucht-Spätfolgen: Mögliche Schädigungen des Gehirns“. FAZ.NET, 20. März 2009. https://www.faz.net/aktuell/wissen/leben-gene/magersucht-spaetfolgen-moegliche-schaedigungen-des-gehirns-1922770.html.
- Weidenauer, Ana, Martin Bauer, Ulrich Sauerzopf, Lucie Bartova, Lukas Nics, Sarah Pfaff, Cecile Philippe, u. a. „On the Relationship of First-Episode Psychosis to the Amphetamine-Sensitized State: A Dopamine D2/3 Receptor Agonist Radioligand Study“. Translational Psychiatry 10, Nr. 1 (8. Januar 2020): 2. https://doi.org/10.1038/s41398-019-0681-5.
- Wildermuth, Volkart. „Das abhängige Gehirn“. Deutschlandfunk, 5. März 2006. https://www.deutschlandfunk.de/das-abhaengige-gehirn-100.html.
- Wissenschaft im Dialog. „Was passiert im Gehirn bei einer Posttraumatischen Belastungsstörung?“ Wissenschaft im Dialog, 16. Juli 2015. https://www.wissenschaft-im-dialog.de/projekte/wieso/artikel/beitrag/was-passiert-im-gehirn-bei-einer-posttraumatischen-belastungsstoerung/.
- Witte, Felicitas. „Kognitive Störungen bei Anorexie – Biomarker weisen auf Hirnschäden durch Untergewicht“. Universimed, 19. Mai 2021. https://www.universimed.com/at/article/neurologie/biomarker-hirnsch%C3%A4den-untergewicht-68122.
- Wolf, Christian. „Pannen beim Gehirn-Umbau – Schizophrenie: eine fehlerhafte Gehirnentwicklung?“ dasGehirn.info – der Kosmos im Kopf, 28. Januar 2013. https://www.dasgehirn.info/krankheiten/schizophrenie/pannen-beim-gehirn-umbau.
- Wollenhaupt-Aguiar, Bianca, Bianca Pfaffenseller, Vinicius De Saraiva Chagas, Mauro A A Castro, Ives Cavalcante Passos, Márcia Kauer-Sant’Anna, Flavio Kapczinski, und Fábio Klamt. „Reduced Neurite Density in Neuronal Cell Cultures Exposed to Serum of Patients with Bipolar Disorder“. International Journal of Neuropsychopharmacology 19, Nr. 10 (Oktober 2016): pyw051. https://doi.org/10.1093/ijnp/pyw051.
- Zwanzger, Peter. „Was passiert bei einer Panikattacke im Gehirn?“ Spektrum.de, 25. Juni 2014. https://www.spektrum.de/frage/wie-entsteht-eine-panikattacke/1287374.


Sei der Erste der einen Kommentar abgibt